Par Angélique Igel-Egalon INRA - Ingénieure de recherche, Inra, source The Conversation.fr
La maladie d'Alzheimer, une maladie contagieuse ?
- Théragora le 15 décembre 2018/FL N° 16 - Page 0

La maladie d'Alzheimer est en augmentation. Shutterstock
Plus d’une cinquantaine de démences résultant de maladies neurodégénératives sont recensées à ce jour, la maladie d’Alzheimer étant la plus largement répandue. On estime aujourd’hui qu’environ 35 millions de personnes en souffrent dans le monde, et que le nombre de malades pourrait atteindre les 115 millions de personnes d’ici 30 ans. Dans notre pays, l’association France-Alzheimer considère que le quart des personnes âgées de plus de 65 ans sera diagnostiqué malade d’Alzheimer d’ici à 2020.
Bien que, dans certains rares cas, la maladie d’Alzheimer puisse être due à un problème génétique, le facteur de risque majeur est le vieillissement. Il est donc logique que la prévalence de ces maladies soit corrélée à l’augmentation de l’espérance de vie.
Mais des travaux récents suggèrent aussi que la maladie d’Alzheimer pourrait, dans certaines conditions, se transmettre entre individus. Son mécanisme rappelle en effet celui des maladies à prions comme la maladie de Creutzfeldt-Jakob, dont des dizaines de cas sont survenus suite à la crise de la vache folle. Explications.
La maladie d’Alzheimer, un problème de protéines
D’un point de vue symptomatique, la maladie d’Alzheimer se manifeste par une détérioration drastique des facultés psychiques et physiques, en raison de la mort des neurones cérébraux. Lorsqu’on analyse les cerveaux des patients décédés de la maladie, on constate la présence de deux types de dépôts constitués de protéines.
Les protéines sont de grosses molécules constituées d’un enchaînement de molécules plus petites, les acides aminés. Il s’agit de composants essentiels de la vie : les cellules et tissus des êtres vivants contiennent des milliers de protéines, dont les fonctions sont variées et spécifiques (hormones, enzymes, protéines de structure comme le collagène, tubuline qui constitue le « squelette » des cellules et leur donne leur forme…). Dans la maladie d'Alzheimer, certaines de ces protéines deviennent anormales et s'accumulent.
Le premier type de dépôts protéiques retrouvés dans le cerveau de patients atteints par la maladie contient une protéine appelée « protéine Tau » (de l’anglais Tubulin-associated unit). En temps normal, l’une de ses fonctions est de stabiliser la structure des neurones. Dans la maladie d’Alzheimer, Tau est modifiée et ne joue plus son rôle. Les neurones dégénèrent, tandis que les protéines anormales s’agrègent entre elles et s’accumulent dans les cellules nerveuses.
Le second type de dépôt est formé par le peptide bêta-amyloïde ou Aβ (les peptides sont des enchaînements d’acides aminés, comme les protéines, mais beaucoup plus courts). Le peptide Aβ provient de la coupure d’une grosse protéine appelée APP. Située à la surface des neurones, APP intervient notamment dans leur croissance, leur survie et leur réparation.
En temps normal, les peptides Aβ sont éliminés, mais dans la maladie d’Alzheimer, ils s’accumulent à l’extérieur des cellules nerveuses, sous forme de plaques amyloïdes, aussi parfois appelées plaques séniles. Ces dépôts se retrouvent également autour des capillaires sanguins du cerveau et peuvent être à l’origine de microhémorragies cérébrales appelées angiopathies amyloïdes cérébrales.
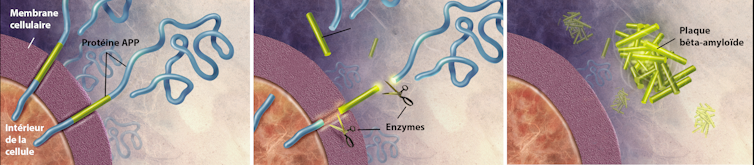
Formation des plaques amyloïdes. Wikimedia, CC BY
Des protéines capables d’en contaminer d’autre
Le point le plus remarquable des mécanismes à l’origine de la maladie d’Alzheimer est que la neurodégénérescence ne découle pas d’une simple accumulation passive de protéines.
En réalité, les protéines impliquées dans la maladie d’Alzheimer changent de forme, ce qui modifie leur action à l’échelle cellulaire. Il faut savoir que le rôle d’une protéine dépend généralement de sa forme (qui elle-même dépend en grande partie de l’enchaînement des acides aminés qui la compose). C’est ce changement de morphologie qui confère au peptide Aβ des propriétés totalement différentes de celles de sa forme normale. Devenu capable de s’auto-agréger, il peut former les dépôts de fibres amyloïdes qui sont probablement à l’origine de la mort des neurones.
Mais ce n’est pas tout : les chercheurs ont démontré que les formes toxiques sont capables de forcer leurs alter-egos normaux à les imiter, et à adopter eux aussi une forme pathogène ! Ce phénomène, dit « auto-réplicatif », explique comment une cellule malade produisant la forme toxique du peptide peut « contaminer » la cellule voisine.
Cette contagion de proche en proche explique aussi pourquoi, durant l’évolution de la maladie d’Alzheimer, la propagation des lésions cérébrales s’étend progressivement à tout le cerveau en suivant un schéma bien déterminé, chez tous les patients.
Des mécanismes qui rappellent ceux des prions
Ce processus auto-réplicatif rappelle ce qui est observé dans le cas d’une autre maladie neurodégénérative, la maladie de Creutzfeldt-Jakob. Cette dernière est due à la propagation au sein du cerveau d’un agent pathogène très particulier : le prion.
Ni bactérie, ni parasite, ni virus, ni champignon, le prion est pourtant transmissible. La découverte de ces « particules protéiques infectieuses » (l’acronyme prion vient de l’anglais proteinacious infectious particule) a fait couler beaucoup d’encre et a obligé les chercheurs à forger un nouveau concept, celui d’« agents transmissibles non conventionnels ». Contrairement aux autres agents pathogènes, les prions sont en effet dépourvus de génome (ils n’ont pas d’ADN ou d’ARN) et sont composés exclusivement d’une seule et même protéine.
Tout comme pour les protéines impliquées dans la maladie d’Alzheimer, les cellules produisent naturellement une version « normale » du prion. Elle remplirait de nombreuses fonctions biologique, mais ses divers rôles sont encore mal connus. Elle possède aussi la propriété de se replier et de s’agréger pour former des particules infectieuses. Sous leur forme infectieuse, les prions sont capables d’infecter un nouvel individu après ingestion de certains tissus contaminés, ou via le sang par exemple.
La grande résistance des prions aux procédés de destruction classiques a été à l’origine de plusieurs crises économico-sanitaires majeures, comme la crise de la vache folle dans les années 1980 et 1990 ou le scandale de l’hormone de croissance contaminée.
La maladie d’Alzheimer est-elle contagieuse ?
Les processus d’agrégation du peptide Aβ et de la protéine Tau présentent des similitudes avec celui observé chez les prions. Est-il possible, dès lors, que la maladie d’Alzheimer puisse se transmettre entre individus, selon le même mécanisme que le prion ? Divers groupes de scientifiques ont cherché à répondre a cette question.
Expérimentalement, plusieurs équipes de chercheurs ont été en mesure d’induire la prolifération d’agrégats de peptides Aβ chez des animaux de laboratoire. Par ailleurs, plus récemment, différents travaux suggèrent l’existence de cas de transmission iatrogène du peptide Aβ pathogène, entraînant des angiopathies amyloïdes cérébrales. Les hormones de croissance produites avant 1977, notamment, n’auraient pas seulement été contaminées par le prion, mais également par le peptide Aβ, et auraient pu être impliquées dans le développement de la maladie d’Alzheimer.
Parallèlement à la publication de ces travaux, une autre population dite « à risque » a été particulièrement détaillée, celle des patients ayant reçu une greffe de dure-mère. Cette fine membrane fibreuse qui protège le cerveau pouvait être prélevée sur des cadavres pour servir de « pansement » suite à des opérations neurochirurgicales invasives. Cette pratique a été interdite en France en 1994, car des greffons de dure-mère ont été à l’origine de cas de transmission iatrogène du prion humain.
Trois études (suisse, japonaise et internationale) ont respectivement montré que 71,4 % 81 % et 61,5 % des patients qui ont reçu ce type de greffe ont ensuite développé des angiopathies amyloïdes cérébrales. Bien que la preuve formelle de la contamination par les greffons ne puisse être apportée, la localisation des lésions et des dépôts protéiques suggèrent très fortement que le greffon est à l’origine du changement de forme et de l’agrégation des peptides Aβ du receveur.
Une étude a également suggéré que les instruments chirurgicaux utilisés en neurochirurgie pourraient peut-être aussi parfois constituer une source de contamination, même si le risque est probablement très limité. Les auteurs de ces travaux suggèrent néanmoins d’améliorer les procédures de stérilisation.
La maladie d’Alzheimer est-elle une maladie à prion ?
D’un point de vue mécanistique, il apparaît clairement que la maladie d’Alzheimer ressemble aux maladies à prions. Si on se cantonne à la définition stricte du mot prion, particule protéique infectieuse, alors la maladie d’Alzheimer devrait en faire partie, étant donné que le caractère transmissible des assemblages protéiques toxiques qui la provoquent a été démontré, au moins expérimentalement.
Toutefois, au fil des résultats de recherche, le concept de prion s’est élargi : l’existence de différentes souches de prion a été révélée, tout comme sa capacité à « muter » et à s’adapter à son nouvel hôte. En cela, les maladies à prions diffèrent de la maladie d’Alzheimer. En l’état actuel des connaissances, il apparaît donc plus juste de qualifier cette dernière de « maladie de type prion » ou « d’amyloïdes infectieux ». Ou d’étendre le terme d’agent transmissible non-conventionnel aux assemblages protéiques responsables de la maladie d’Alzheimer.
Par Angélique Igel-Egalon, Ingénieure de recherche, Inra
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.










