Par l'équipe de Frédéric Saudou, Directeur de Grenoble Institut des Neurosciences (GIN ' Inserm/UGA) et Benoit Charlot, de l'Institut d'électronique des systèmes (CNRS/Université de Montpellier),
Des puces pour modéliser et mieux comprendre la maladie de Huntington
En combinant l’utilisation de neurones issus de souris modèles de la maladie de Huntington, une maladie neurologique d’origine génétique, et la technologie microfluidique, l’équipe de Frédéric Saudou, Directeur de Grenoble Institut des Neurosciences (GIN – Inserm/UGA) et responsable de l’équipe « Dynamiques intracellulaires et neurodégénérescence », en collaboration avec Benoit Charlot, de l’Institut d’électronique des systèmes (CNRS/Université de Montpellier), a reconstitué sur une puce le circuit neuronal atteint chez les patients. Cette étude qui a permis d’identifier un nouveau mécanisme pathogénique, a été publiée dans la revue Cell Reports le 2 janvier 2018.
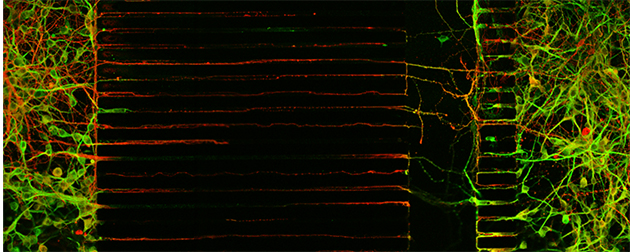
Réseau neuronal de la maladie de Huntington dans une puce microfluidique. Deux populations de neurones différents sont connectées via des canaux d’une taille de 3 microns et de plusieurs centaines de microns de long. Les neurones de gauche étendent des prolongements appelés axones (en rouge) qui vont atteindre la chambre centrale. Les axones vont alors se connecter et former des synapses avec les dendrites (extensions plus courtes, en vert) provenant des neurones de droite et ainsi former un circuit neuronal fonctionnel. Ce circuit est atteint dans la maladie de Huntington.
La maladie de Huntington est une affection d’origine génétique qui touche en France environ 6 000 personnes, et concerne plus de 12 000 porteurs du gène muté, provisoirement indemnes de signes cliniques. Elle est caractérisée par des troubles cognitifs, psychiatriques et des mouvements incontrôlés.
Le gène HTT, responsable de la maladie, synthétise une protéine, la huntingtine, impliquée dans la régulation des dynamiques intracellulaires. À l’état normal, cette protéine contient des répétitions d’un acide aminé, la glutamine. Des répétitions qui peuvent devenir dangereuses : à partir d’un certain seuil (36 glutamines), la huntingtine est mutante et induit la maladie. Et plus les répétitions sont nombreuses, plus les symptômes apparaissent tôt.
Une des caractéristiques de la maladie est la dysfonction du circuit corticostriatal qui connecte deux régions du cerveau, le cortex et le striatum. Ces deux régions expriment la protéine mutante et dégénèrent dans la maladie de Huntington mais les mécanismes cellulaires impliqués sont encore mal compris. Jusqu’à présent, il était très difficile d’étudier les altérations du circuit avec une résolution subcellulaire.
Grace à l’approche microfluidique qui consiste à fabriquer dans un matériau biocompatible et transparent des chambres de culture et des canaux à l’échelle des cellules, les chercheurs ont pu contrôler la pousse et l’orientation des axones dans des canaux micrométriques pouvant atteindre jusqu’à 500 microns de longueur afin de reconstituer le circuit corticostriatal. Cette étude identifie ainsi les étapes critiques qui étaient altérées lorsque les neurones expriment la huntingtine mutante avec une résolution spatiotemporelle inédite. Cette étude montre le rôle fondamental du cortex dans la genèse des dysfonctions au niveau du circuit entier. En effet, grâce au système microfluidique, les chercheurs ont pu isoler les neurones du cortex et du striatum dans des compartiments identifiés afin de reconstituer des circuits hybrides contenant un cortex sain avec un striatum malade, et vice versa. L'équipe a ainsi montré que des neurones de cortex malade sont suffisants pour induire les dysfonctions du circuit alors même que les neurones du striatum sont sains. À l’inverse, des neurones corticaux sains sont capables de sauver les neurones du striatum malade.
Ces travaux permettent de mieux comprendre comment la huntingtine mutante induit la dysfonction et la mort sélective de ces deux régions du cerveau. Ces résultats devraient permettre de développer des stratégies thérapeutiques mieux adaptées pour les patients puisqu'elle identifie le cortex comme une cible d’importance pour empêcher la neurodégénerescence du striatum.
Ce modèle représente également une nouvelle approche pour tester et valider des molécules à intérêt thérapeutique.
Référence : Virlogeux A, Moutaux E, Christaller W, Genoux A, Bruyère J, Fino E, Charlot B, Cazorla M, Saudou F. Reconstituting Corticostriatal Network On-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports, In Press.










